LISTA 1 DE EXERCÍCIOS - 1º ano
Exercícios - Estados físicos e mudanças
1. (Cesgranrio-RJ adaptado) Um cientista recebeu uma substância desconhecida, no estado sólido, para ser analisada. A tabela abaixo representa o processo de aquecimento de uma amostra dessa substância.
|
Tempo(min) |
0 |
10 |
20 |
30 |
40 |
50 |
60 |
70 |
|
Temperatura (ºC) |
20 |
40 |
40 |
40 |
70 |
70 |
70 |
90 |
Analisando a tabela, podemos concluir que a amostra apresenta:

6. Quanto tempo durou o aquecimento do líquido?
a) 1 b) 2 c) 3 d) 4 e) 5;
7. Qual a temperatura da substância, transcorrido 5 minutos de aquecimento?
a) 10 b) 20 c) 30 d) 40 e) 50
8. Considerando um resfriamento dessa substância, qual seria o seu ponto de solidificação, em ºC?
a) 80 b) 50 c) 10 d) -20 e) -10
9. Utilizando a mesma abordagem da questão anterior, qual o ponto de liquefação, em ºC?
a) 80 b) 50 c) 10 d) -20 e) -10
10. Como se denomina a mudança do estado sólido para o estado gasoso?
a) fusão b) solidificação c) liquefação
d) sublimação e) ebulição
11. O gráfico abaixo representa a variação de temperatura observada ao se aquecer uma substância X durante cerca de 7 minutos. Observe e responda as questões 12 a 14:

12. Qual a faixa de temperatura, em ºC, em que a substância X permanece sólida?
a) 0 a 20 b) 10 a 20 c) 20 a 40 d) 20 a 60 e) 40 a 60
13 Qual a faixa de temperatura, em ºC, em que a substância X permanece líquida?
a) 0 a 20 b) 10 a 20 c) 20 a 40
d) 20 a 60 e) 40 a 60
14. Qual o ponto de ebulição da substância X?
a) 0ºC b) 10ºC c) 20ºC d) 40ºC e) 50ºC
15. Uma determinada substância foi resfriada durante 80 minutos, produzindo o gráfico a seguir. Analise-o e responda as próximas questões:
-
16. Qual a temperatura, em ºC, quando o tempo era de 35 minutos?
a) 70 b) 60 c) 50 d) 40 e) 30
17. Transcorridos 5 minutos após o início do resfriamento, qual era a temperatura, em ºC?
a) 90 b) 80 c) 70 d) 65 e) 50
18. Qual era a temperatura da substância, em ºC, após uma hora de resfriamento?
a) 90 b) 70 c) 50 d) 30 e) 10
19. Após 40 minutos, qual era a diferença de temperatura da substância em relação à temperatura inicial?
a) 80 b) 60 c) 40 d) 30 e) 20
20. (UFMG) Observe a tabela que apresenta as temperaturas de fusão e ebulição de algumas substâncias:
Substância
ponto de fusão (ºC)
Ponto de ebulição (ºC)
I
-117,3
78,5
II
-93,9
65,0
III
801
1413
IV
3550
4827
V
-95
110,6
Em relação aos estados físicos das substâncias, a alternativa correta é:
a) I é sólido a 25ºC b) II é líquido a 80ºC
c) III é líquido a 1000ºC d) IV é gasoso a 3500ºC
e) V é sólido a 100ºC
21. (PUC-MG) Seja dada a seguinte tabela:
|
|
ponto de fusão (ºC) |
Ponto de ebulição (ºC) |
|
Pentano |
-130 |
36,1 |
|
Fenol |
43 |
182 |
|
Clorofórmio |
-63 |
61 |
|
Cloro |
-101 |
-34,5 |
De cima para baixo, a 25ºC e 1 atm, os estados físicos dos compostos, são, respectivamente:
a) líquido, sólido, líquido, gás b) sólido, sólido, gás, gás
c) líquido, líquido, sólido, gás d) sólido, sólido, gás, líquido
e) líquido, líquido, líquido, gás
22. (UFES) Dada a tabela em relação ao estado físico das substâncias, a alternativa correta é:
|
substância |
ponto de fusão (ºC) |
Ponto de ebulição (ºC) |
|
I |
-218 |
-183 |
|
II |
-63 |
61 |
|
III |
41 |
182 |
|
IV |
801 |
1473 |
|
V |
1535 |
2885 |
a) I é sólido a 30ºC b) II é líquido a 100º
c) III é sólido a 25º d) IV é líquido a 480ºC
e) V é gasoso a 2400ºC
23. (PUC-MG) Numa praia, em pleno verão, um estudante de Química observou que o carrinho de picolé usava "gelo-seco" para retardar o degelo dos picolés. Pediu à vendedora um pedaço de gelo e colocou-o num copo com água, ocorrendo formação de "fumaças brancas". Observou-se então o fenômeno de:
a) evaporação b) Sublimação c) Fusão
LISTA DE EXERCÍCIOS - Estudo do átomo
01. Um átomo de número atômico Z e número de massa A:
a) tem A nêutrons. b) tem A elétrons. c) tem Z prótons.
d) tem A – Z nêutrons. e) tem Z elétrons.
02. (FUVEST) O átomo constituído de 17 prótons, 18 nêutrons e 17 elétrons, possui número atômico e número de massa igual a: a) 17 e 17 b) 17 e 18 c) 18 e 17 d) 17 e 35 e) 35 e 17
03. (FUVEST) A seguinte representação , X = símbolo do elemento químico, refere-se a átomos com:
a) Igual número de nêutrons; b) Igual número de prótons;
c) Diferentes números de elétrons; d) Diferentes números de atômicos;
e) Diferentes números de oxidação;
04. (MACK) Indique a alternativa que completa corretamente as lacunas do seguinte período: “Um elemento químico é representado pelo seu ___________ , é identificado pelo número de __________ e pode apresentar diferente número de __________ .”
a) nome – prótons – nêutrons. b) nome – elétrons – nêutrons.
c) símbolo – elétrons – nêutrons. d) símbolo – prótons – nêutrons.
e) símbolo – – elétrons – nêutrons.
05.(Unifor – CE) Dentre as espécies químicas:
![]()
![]()
as que representam átomos cujos núcleos possuem 6 nêutrons são:

07. (UFG – GO) O número de prótons, nêutrons e elétrons representados por ![]() é, respectivamente:
é, respectivamente:
a) 56, 82 e 56 b) 56, 82 e 54 c) 56, 82 e 58
d) 82, 138 e 56 e) 82, 194 e 56
-
08. O número atômico (Z) e o número de massa (A) de um íon monoatômico com carga 3+ que contém 10 elétrons e 14 nêutrons são, respectivamente:
a)13, 27 b)24, 21 c)14, 24 d)13, 24 e)14, 27
Lista de Exercícios sobre Tabela Periódica
1) Um elemento X tem o mesmo número de massa do 20Ca40e o mesmo número de nêutrons do 19K41. Este elemento está localizado na família:
(A) IA.
(B) IIA.
(C) VIA.
(D) VIIA.
(E) zero.
Observe a colocação dos elementos na tabela periódica proposta, representados por símbolos que não correspondem aos verdadeiros e responda as duas questões que seguem.
2) O metal alcalino é:
(A) Z.
(B) Q.
(C) X.
(D) U.
(E) Y.
3) Os elementos P e U são, respectivamente, pertencentes às famílias dos:
(A) alcalinos e alcalinos terrosos.
(B) halogênios e calcogênios.
(C) calcogênios e gases nobres.
(D) calcogênios e halogênios.
(E) alcalinos terrosos e boro.
4) Na classificação periódica, os elementos químicos situados nas colunas 1A e 2A são denominados, respectivamente:
(A) halogênios e metais alcalinos.
(B) metais alcalinos e metais alcalinos terrosos.
(C) halogênios e calcogênios.
(D) metais alcalinos e halogênios.
(E) halogênios e gases nobres.
5) Considerando os elementos X (Z = 17) e Y (Z = 12), podemos afirmar que:
(A) X é metal e Y é ametal.
(B) X e Y são metais.
(C) X é ametal e Y é metal.
(D) X e Y são ametais.
(E) X e Y são semimetais.
6) O elemento químico que apresenta configuração eletrônica 2, 8, 2 é um:
(A) actinídeo.
(B) lantanídeo.
(C) metal alcalino terroso.
(D) elemento de transição.
(E) elemento transurânico.
7) São considerados gases nobres:
(A) Hélio, Neônio, Xenônio, Germânio, Radônio.
(B) Criptônio, Neônio, Radônio, Titânio, Hélio.
(C) Argônio, Hélio, Neônio, Escândio, Radônio.
(D) Hélio, Xenônio, Radônio, Estrôncio, Neônio.
(E) Radônio, Criptônio, Argônio, Neônio, Xenônio.
8) Diga qual é a afirmação correta em relação ao elemento cujo átomo tem configuração eletrônica no estado fundamental: 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p1
(A) É não metal, tem 4 níveis de energia e localiza-se no grupo 3A da tabela periódica.
(B) É não metal, tem 3 elétrons no nível de valência e localiza-se no terceiro período da tabela periódica.
(C) É metal, tem 4 níveis de energia e localiza-se no grupo 1A da tabela periódica.
(D) É metal, tem 4 níveis de energia e localiza-se no grupo 3 A da tabela periódica.
(E) É não metal, tem 1 elétron no nível de valência e localiza-se 4º período da tabela periódica.
9) O espetáculo de cores que e visualizado quando fogos de artifício são detonados deve-se a presença de elementos químicos adicionados a pólvora. Por exemplo, a cor amarela e devido ao sódio; a vermelha, ao estrôncio e ao cálcio; a azul, ao cobre; a verde, ao bário; e a violeta, ao potássio.
Sobre os elementos químicos mencionados no texto, é correto afirmar:
(A) O sódio e o cálcio são metais alcalinos.
(B) O estrôncio e o bário são metais alcalino-terrosos.
(C) O potássio e o bário são metais alcalino-terrosos.
(D) O cálcio é metal alcalino, e o cobre é metal de transição.
(E) O cobre é metal de transição, e o potássio é metal alcalino-terroso.
10) Um átomo apresenta normalmente 2 elétrons na primeira camada, 8 elétrons na segunda camada, 18 elétrons na terceira camada e 7 elétrons na quarta camada. A família e o período em que se encontra este elemento são, respectivamente:
(A) família dos halogênios, 7° período.
(B) família do carbono, 4° período.
(C) família dos halogênios, 4° período.
(D) família dos calcogênios, 4° período.
(E) família dos calcogênios, 7° período.
Lista de Exercícios sobre Isótopos, Isóbaros e Isótonos nº 01
Questão 1
Determine o número atômico e o número de massa dos átomos A e B, que são isóbaros e apresentam a seguinte representação:
10+x 5xA 11+x4x+8B
Questão 2
X é isótopo de 2041Ca e isótono de 1941K. Portanto, o seu número de massa é igual a:
a) 41 b) 40 c) 39
d) 42 e) 20
Questão 3
(Unisinos –RS) Segundo dados experimentais, o oxigênio do ar que respiramos tem exatos 99,759% de 8O16, 0,037% de átomos de 8O17 e 0,204% de 8O18. Diante desta constatação pode-se afirmar que essas três fórmulas naturais do oxigênio constituem átomos que, entre si, são:
a) Alótropos.
b) Isóbaros.
c) Isótonos.
d) Isótopos.
e) Isômero.
Questão 4
(UCS-RS) Isótopos são átomos que apresentam o mesmo número atômico, mas diferentes números de massa. O magnésio possui isótopos de números de massa iguais a 24, 25 e 26. Os isótopos do magnésio possuem números de nêutrons, respectivamente, iguais a: (Dado: Mg possui Z = 12)
a) 1, 12 e 12 b) 24, 25 e 26 c) 12, 13 e 14 d) 16, 17 e 18 e) 8, 8 e 8
Respostas
- Resposta Questão 1
Primeiramente, precisamos saber o valor de x. Visto que A e B são isóbaros, isto é, o número de massa deles é igual (número que fica na parte superior), podemos igualá-los:
5 x = 4x + 8
5x – 4x = 8
x = 8
Agora basta substituir x nas representações:
Número de massa de A:
A = 5x = 8 . 8 = 40
Número atômico de A:
Z = 10 + x = 10 + 8 = 18
- Número de massa de B:
A = 4x + 8 = 4 . 8 + 8 = 40
- Número atômico de B:
Z = 11 + x = 11 + 8 = 19
Assim, temos: 1840A e 1940B
- Resposta Questão 2
Alternativa “d”
Se X é isótopo de 2041Ca, então seu números atômico ou de prótons é igual a 20. E como ele é isótono de 1941K, então seu número de nêutrons é 41-19 = 22. Para descobrir seu número de massa, basta somar seus prótons com seus nêutrons:
A = P + n
A = 20 + 22
A = 42
- Resposta Questão 3
Alternativa “d”.
As três formas naturais de oxigênio constituem átomos isótopos. Veja que o valor do número atômico, que é o mesmo que o número de prótons e que fica na parte inferior de todos, é igual a 8.
- Resposta Questão 4
Alternativa “c”.
O magnésio possui números de massa iguais a 24, 25 e 26. Desse modo, temos: A = n + p → n = A –p
n = 24 – 12 → n = 12
n = 25 – 12 → n = 13
n = 26 – 12 →n = 14
Lista de Exercícios sobre Isótonos, Isóbaros e Isótopos nº 02
01. (ABC) O deutério é um:
a) Isóbaro de hidrogênio.
b) Isótopo de hidrogênio.
c) Radioisótono do hidrogênio.
d) Isômero do hidrogênio.
e) Alótropo do hidrogênio.
![]()
a) isótopos.
b) alótropos.
c) isóbaros.
d) isômeros.
e) isótopos.
03. (ITA) São definidas quatro espécies de átomos neutros em termos de partículas nucleares:
Átomo I – possui 18 prótons e 21 nêutrons
Átomo II – possui 19 prótons e 20 nêutrons
Átomo III – possui 20 prótons e 19 nêutrons
Átomo IV – possui 20 prótons e 20 nêutrons
Pode-se concluir que:
a) os átomos III e IV são isóbaros;
b) os átomos II e III são isoeletrônicos;
c) os átomos II e IV são isótopos;
d) os átomos I e II pertencem ao mesmo período da Classificação Periódica;
e) os átomos II e III possuem o mesmo número de massa.
04. (MACK) Assinale a alternativa incorreta:![]()
b) Isótopos são átomos de diferentes números atômicos e iguais número de nêutrons.
![]()
d) Isótonos são átomos de elementos diferentes e iguais número de nêutrons. e) n.d.a.
05. (PUC-RIO) Os isótopos ![]() possuem respectivamente os seguintes números de nêutrons:
possuem respectivamente os seguintes números de nêutrons:
a) 8, 8, 8
b) 8, 9, 10
c) 16, 17, 18
d) 24, 25, 26
e) 18, 17, 16
06. (PUC – RIO) Os fenômenos isotopia, isobaria e alotropia são representados respectivamente pelos exemplos:
isótopos isóbaros alótropos
a) O2; O3 ![]()
![]()
b) 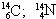
![]() O2; O3
O2; O3
c) O2; O3 ![]()
![]()
d) ![]() O2; O3
O2; O3 ![]()
e) ![]()
![]() O2; O3
O2; O3
07. Têm-se os seguintes átomos e íons genéricos:
![]()
São, respectivamente, isoeletrônicos, isótopos, isóbaros, isótonos e pertencem ao mesmo elemento químico os seguintes pares:
a) B1+ e E2+ / A e D / C e F / B e E / A e D
b) B1+ + E2+ / C e F / A e D / C e B / B e D
c) A1+ + F / B e C / C e E / B e D / A e D
d) A1+ e E2+ / A e D / C e F / B e E / A e D
e) C e F / A e D / B e E / A e F / B e C
Resolução:
| 01. B | 02. C | 03. E | 04. B |
| 05. B | 06. E |
07. A |
